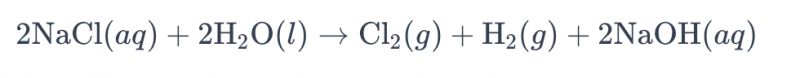تُعرف عملية التحليل الكهربائي لمحلول ملحي باستخدام أقطاب التيتانيوم لإنتاج الكلور باسم "التحليل الكهربائي للمحلول الملحي". في هذه العملية، تُستخدم أقطاب التيتانيوم لتسهيل تفاعل أكسدة أيونات الكلوريد في المحلول الملحي، مما يؤدي إلى توليد غاز الكلور. المعادلة الكيميائية العامة للتفاعل هي كما يلي:
في هذه المعادلة، تتأكسد أيونات الكلوريد عند المصعد، مُنتجةً غاز الكلور، بينما تُختزل جزيئات الماء عند المهبط، مُنتجةً غاز الهيدروجين. إضافةً إلى ذلك، تُختزل أيونات الهيدروكسيد عند المصعد، مُنتجةً غاز الهيدروجين وهيدروكسيد الصوديوم.
يعود اختيار أقطاب التيتانيوم إلى مقاومتها الممتازة للتآكل وتوصيلها الكهربائي، مما يسمح لها بالتفاعل بثبات أثناء التحليل الكهربائي دون تآكل. وهذا يجعلها خيارًا مثاليًا للتحليل الكهربائي للمحلول الملحي.
يتطلب التحليل الكهربائي للمياه المالحة عادةً مصدر طاقة خارجيًا لتوفير الطاقة اللازمة للتفاعل الكهربائي. يكون مصدر الطاقة هذا عادةً تيارًا مستمرًا (DC)، لأن التفاعلات الكهربائية تتطلب تيارًا ثابت الاتجاه، ويمكن لمصدر الطاقة المستمر توفير تيار مستمر الاتجاه.
في عملية التحليل الكهربائي للمياه المالحة لإنتاج غاز الكلور، يُستخدم عادةً مصدر طاقة تيار مستمر منخفض الجهد. يعتمد جهد مصدر الطاقة على ظروف التفاعل وتصميم المعدات، ولكنه يتراوح عادةً بين 2 و4 فولت. إضافةً إلى ذلك، تُعدّ شدة تيار مصدر الطاقة معيارًا أساسيًا يجب تحديده بناءً على حجم غرفة التفاعل وعائد الإنتاج المطلوب.
باختصار، يعتمد اختيار مصدر الطاقة لتحليل المياه المالحة كهربائياً على المتطلبات المحددة للتجارب أو العمليات الصناعية لضمان التفاعل الفعال والحصول على المنتجات المطلوبة.
وقت النشر: ١٦ يناير ٢٠٢٤